Wirkstoff-Forschung Hoffnung im Kampf gegen Parasiten
Millionen Menschen erkranken jedes Jahr an Chagas oder der Schlafkrankheit. Auslöser sind spezielle Parasiten, die sich von den Tropen nach Europa ausbreiten. Forschende haben eine Schwachstelle dieser Parasiten entdeckt. Sie kann der Schlüssel für einen mitunter lebensrettenden Wirkstoff sein.
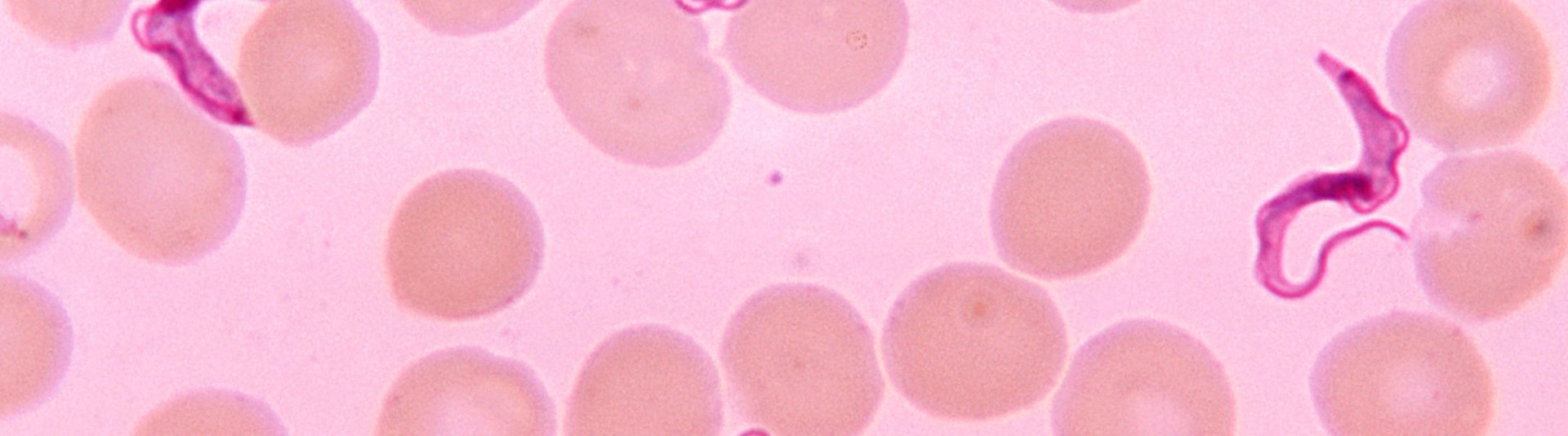
Zurück ins Jahr 1834: Was der ungarische Arzt David Gruby damals in einem Blutausstrich unter seinem Mikroskop entdeckte, beschäftigt die Wissenschaft noch heute. Trypansomen nannte er die kleinen einzelligen Wesen, die als Geißel-Parasiten Säugetiere befallen. Die Übertragung der sich „bohrend“ fortbewegenden Parasiten (trypanon = griech. Bohrer) erfolgt meist über Insekten. Zunächst wurden die Parasiten als Erreger für Tierkrankheiten bekannt. Heute wissen wir: Auch der Mensch kann diesen Parasiten zum Opfer fallen.
Wachsende Gefahr in Europa
Für die Übertragung in den Menschen sind vor allem Raubwanzen und Tsetsefliegen als Zwischenwirte verantwortlich. Die befallenen Insekten stechen die Person und der Trypansom bohrt sich an sein Ziel. Insbesondere in tropischen Regionen wie Lateinamerika und Afrika sind dadurch verursachte Krankheiten wie Chagas oder die Schlafkrankheit eine ernste Gefahr für die Gesundheit der Menschen. Da Trypansomen auch vor Ländergrenzen keinen Halt machen und die Temperaturen weltweit steigen, fühlen sie sich mittlerweile auch in Nordamerika und Europa immer wohler. Gegenwärtig gibt es keine Heilungsmöglichkeiten für Chagas oder die Schlafkrankheit und verfügbare Medikamente linderen die Symptome nur mit starken Nebenwirkungen. Zudem bilden sich bereits Resistenzen gegen diese Wirkstoffe aus.
Bildergalerie
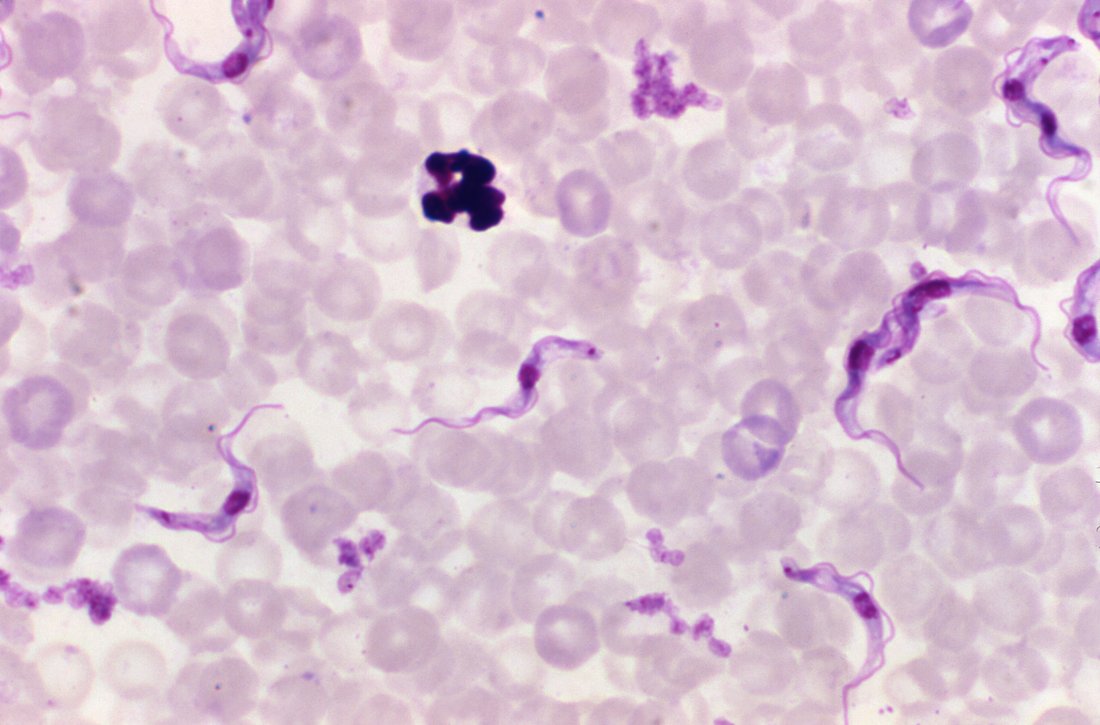


Parasitekrankheiten mit schwerwiegenden Folgen
Bei der Chagas-Krankheit stechen Raubwanzen Menschen in die Haut und übertragen den Parasiten über die Stichwunde. Nach der ersten Infektion bricht die Chagas-Krankheit oftmals erst nach einer langen Latenzzeit (Jahre bis Jahrzehnte) aus. Zunächst äußert sie sich durch grippeähnliche Symptome, kann jedoch durch Komplikationen am Herzen und im Magen-Darm-Bereich bis zum Tod führen. In manchen Fällen kommt es noch viele Jahre später zu Komplikationen wie Herzmuskelentzündungen. Größte Herausforderung ist es, Infizierte ohne Symptome ausfindig zu machen und frühzeitig zu behandeln. Menschen können sich über Kontakt mit Blut auch untereinander infizieren.
Die Schlafkrankheit, oder Afrikanische Trypanosomiasis, wird über den Speichel der Tsetsefliege übertragen. Auch sie bricht erst einige Wochen nach der Stich-Infektion aus. Typische Symptome reichen von Hautauschlag bis Schüttelfrost. In den Monaten darauf kommt es bei den Erkrankten neben Konzentrations- und Koordinationsproblemen zu Schlafstörungen, die letztendlich in einer „Schlafsucht“ enden. Die betroffenen Personen verfallen dabei in einen dauerhaften Dämmerzustand, der der Krankheit ihren Namen verleiht.
Hoffnung aus München
Große Hoffnung macht die Forschungsgruppe um Michael Sattler und Grzegorz Popowicz, die gemeinsam mit Kolleg:innen anderer Einrichtungen seit Jahren an der Entwicklung eines neuen Medikamentes gegen Parasitenkrankheiten arbeitet. Und das mit Erfolg: Sie fanden eine Möglichkeit, den Krankheiterreger auszuschalten. Wie alle Lebewesen haben Trypanosome einen Stoffwechsel, der ihr Überleben ermöglicht. Greift man diesen Stoffwechsel gezielt an, stirbt der Parasit. Expert:innen für Biologie, Chemie, Medizin und vielen weiteren Bereichen arbeiteten jahrelang daran, diese Idee zu verwirklichen. Im Jahr 2017 kann der Durchbruch: Die Forschenden fanden gewissermaßen einen Schlüssel zum Schloss.
Wirkstoff-Forschung nach dem Schlüssel-Schloss-Prinzip
Sie wussten, dass die Proteine PEX14 und PEX5 zentral am Stoffwechsel der Parasiten beteiligt sind und somit das ideale Angriffsziel darstellen. Am Bayerischen NMR-Zentrum, das gemeinsam von Helmholtz Munich und der Technischen Universität München betrieben wird, untersuchten sie deshalb mit Hilfe der Kernspinresonanz (engl.: nuclear magnetic resonance, NMR)-Spektroskopie die genaue Raumstruktur der Zielproteine, um das “Schloss” zu vermessen. Anhand der Struktur bauten sie den “Schlüssel”: ein Molekül, das perfekt an PEX14 bindet und so die Wechselwirkung mit PEX5 verhindert und den Parasiten abtötet.
Nächster Schritt: Klinische Studie
Seither arbeiten die Wissenschaftler:innen daran, das Molekül in punkto Wirksamkeit und Sicherheit weiterzuentwickeln. Sie wollen es in klinischen Studien testen und schließlich damit ein neues Medikament herstellen. Außerdem untersuchen sie, ob auch andere einzellige Parasiten für ihr Überleben auf ähnliche Proteine angewiesen sind. Denn dann würde sich der neue Ansatz aus München auch für die Bekämpfung weitere Parasitenkrankheiten wie Leishmaniosen anbieten. Für ihr Vorhaben erhielt die Gruppe bereits eine Millionenförderung des Bundesministeriums für Bildung und Forschung (BMBF) und wurde mit dem Erwin-Schrödinger-Preis 2020 ausgezeichnet.
Letzte Aktualisierung: Juni 2022.






